

脐带血是新生儿脐带被结扎后存留在脐带和胎盘中的血液。科学研究发现,脐带血中含有丰富的可以重建人体造血和免疫系统的造血干细胞,以及其他干细胞,在再生医学当中具有广泛应用。在多种难治性疾病的治疗方面有着显著的效果。另外脐带血作为珍贵的医疗资源,目前属于不可再生的资源,但有多项研究都在为脐带血的体外扩增提供策略,其中包括将间充质干细胞与造血干细胞共培养可显著提升造血干细胞体外增殖剂量。
这篇由Mansoureh Ajami等人研究发表的文章详细介绍了基质细胞衍生因子-1(SDF-1)和膜同种型的SCF间充质干细胞共培养脐血CD34+的比较。其中文章指出脐带血的体外增殖对治疗多种疾病具有重要意义。这项研究的目的是通过与过度表达基质细胞衍生因子-1(SDF-1),干细胞因子可溶性和膜同工型(sSCF/mSCF)的间充质干细胞(MSC)共培养来扩增CD34+HSC。目的是保持MSC过表达的细胞因子的结构和功能,可对CD34+HSC的扩增产生积极作用。
研究人员通过从脐血单个核中分离获得MSCs和HSC,使用SCF、mSCF和SDF-1表达载体对UCB MSC进行核转染,将分离的脐带血造血干细胞与转染成功的MSC进行共培养,对照组选择未处理的MSC,在相同的培养基进行培养。
结果显示在过度表达mSCF/sSCF/SDF-1的MSC共培养体系中CD34+HSC扩增能力达到4.73±0.26倍,克隆能力(5.3±0.25倍)和CXCR4(一种G蛋白偶联受体)的转录水平增加,HOXB4和BMI1同样增加(分别为3.49±0.13、9.49±0.78和11.6±0.9倍)。从此结论得出UCB MSCs在共培养系统中过表达SCF和SDF-1对UCB HSCs的对扩增造血干细胞具有明显作用。此外,研究也表明经转染的MSC可以替代HSC扩增培养基中的rhu SCF(重组人生长因子)。

图:MSC共培养7天后,UCB CD34+HSC的CFC测定结果,其中图6为CFU粒细胞/单核细胞(CFU-GM)
脐带血造血干细胞为什么可以在与MSC共培养中进行多倍扩增,主要原因之一是SDF-1与SCF可以通过G2/M期调节细胞周期进程。与此同时CD34+HSC/MSC共培养系统中高水平的SDF-1导致下调了涉及的多种细胞因子和趋化因子自我更新抑制造血干细胞和祖细胞。SDF-1通过与其独特的受体CXCR4(一种G蛋白偶联受体)相互作用而发挥这种作用。SCF有效的调控HSC增殖、存活和分化。
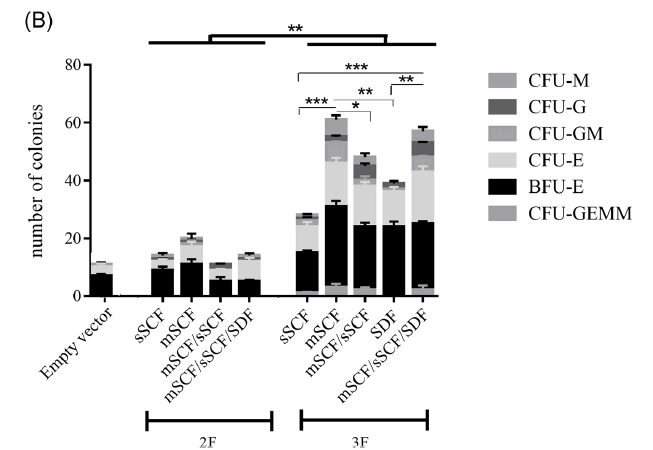
图:比较在各种培养条件下扩展的UCB CD34+HSCs的不同克隆形成能力
除间充质干细胞与造血干细胞共培养系统外,在1990年华盛顿西雅图弗雷德·哈钦森癌症研究中心的研究人员开发了无血清离体HSC培养系统,该系统由固定化的Delta1 Notch配体以及早期起作用的HSC细胞因子(干细胞因子(SCF),血小板生成素(TPO),Flt3)组成配体,该研究分离的CD34+为脐血中分离获得,可对造血干细胞进行体外增殖。另外UM171造血干细胞激动剂的应用也具有广阔的应用前景,主要原因,UM171可调控内皮蛋白C受体(EPCR)的表达,进而起到推动造血干细胞增殖。
那么归根结底,人们为什么要研究脐带血体外扩增技术呢,它可以带来哪些医疗前景呢?首先,前文也提到脐带血是珍贵的医疗资源目前还处于不可再生的阶段,如果体外扩增技术应用到临床,相信这绝对是一个革命性的医疗成果,对于相关疾病的治疗也会起到积极的推动作用,其次脐血体外扩增技术,涉及到多种细胞因子联动作用,对于脐血治疗疾病的机理研究具有重要意义。如果脐带血扩增技术最终得到推广,今后只需采集少量的脐带血作为“种子”就可以满足患者临床移植的需要,乃至于储存单份脐带血就能通过扩增满足自身和家庭成员的重复使用,最大限度造福患者。

