我首次解析人类溶酶体维生素B12外排蛋白ABCD4的运转机制
来源: 科技日报
2019-09-03 14:57:09
记者从中国科学技术大学获悉,该校微尺度物质科学国家研究中心和生命科学与医学部陈宇星教授和周丛照教授课题组与孙林峰教授课题组合作,利用冷冻电镜技术首次解析了人类溶酶体维生素B12外排蛋白ABCD4的近原子分辨率三维结构,为深入理解该类膜蛋白转运的分子机制,以及其突变引发疾病的致病机理提供了基础。该研究成果以2019年8月29日在线发表在《细胞研究》上。
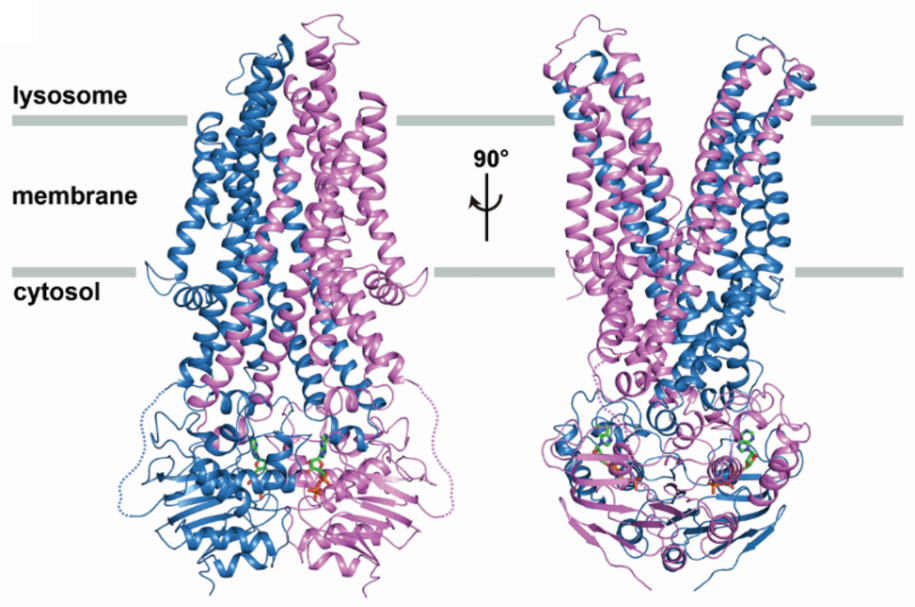 维生素B12仅能在自然界少数细菌和古细菌中合成,而其作为一种人类必需的营养物质,只能从食物中摄取。维生素B12通过受体介导的内吞作用进入细胞,随后以游离形态储存于溶酶体中,需要时外排至细胞质而被利用。研究表明,人类ATP结合盒式(ABC)转运蛋白ABCD4定位于溶酶体膜上,可能在溶酶体内维生素B12外排至细胞质过程中起到关键作用。ABCD4基因的突变可能导致一系列先天性维生素B12缺陷病。其症状表现为肌张力减退、骨髓抑制、巨红细胞性贫血和心脏病等。然而,溶酶体内维生素B12外排的分子机制却不清楚,制约了对相关疾病的深入了解和治疗。
科研人员对临床上该蛋白的突变体致病机理进行分析。研究发现,临床样本的突变会破坏蛋白质分子内部(引入二硫键)或与ATP分子之间(盐桥)的相互作用,或者使蛋白错误折叠,最终导致蛋白无法正常催化ATP水解或发生构想变化,引发相关疾病。研究人员又将这些突变版本的蛋白构建在脂质体上利用生化活性进一步验证了结构分析的预测。同时,基于结构他们提出了ABCD4的转运机制。由于定位于溶酶体膜上,ABCD4采用不同于经典ABC外排蛋白的反向转运机制来外排维生素B12。
该项研究不仅对于该类蛋白的分子结构研究具有重要的参考意义,也为相关疾病的致病机理研究以及药物开发设计提供了理论指导。
维生素B12仅能在自然界少数细菌和古细菌中合成,而其作为一种人类必需的营养物质,只能从食物中摄取。维生素B12通过受体介导的内吞作用进入细胞,随后以游离形态储存于溶酶体中,需要时外排至细胞质而被利用。研究表明,人类ATP结合盒式(ABC)转运蛋白ABCD4定位于溶酶体膜上,可能在溶酶体内维生素B12外排至细胞质过程中起到关键作用。ABCD4基因的突变可能导致一系列先天性维生素B12缺陷病。其症状表现为肌张力减退、骨髓抑制、巨红细胞性贫血和心脏病等。然而,溶酶体内维生素B12外排的分子机制却不清楚,制约了对相关疾病的深入了解和治疗。
科研人员对临床上该蛋白的突变体致病机理进行分析。研究发现,临床样本的突变会破坏蛋白质分子内部(引入二硫键)或与ATP分子之间(盐桥)的相互作用,或者使蛋白错误折叠,最终导致蛋白无法正常催化ATP水解或发生构想变化,引发相关疾病。研究人员又将这些突变版本的蛋白构建在脂质体上利用生化活性进一步验证了结构分析的预测。同时,基于结构他们提出了ABCD4的转运机制。由于定位于溶酶体膜上,ABCD4采用不同于经典ABC外排蛋白的反向转运机制来外排维生素B12。
该项研究不仅对于该类蛋白的分子结构研究具有重要的参考意义,也为相关疾病的致病机理研究以及药物开发设计提供了理论指导。
[ 责任编辑:姜祎男 ]


 维生素B12仅能在自然界少数细菌和古细菌中合成,而其作为一种人类必需的营养物质,只能从食物中摄取。维生素B12通过受体介导的内吞作用进入细胞,随后以游离形态储存于溶酶体中,需要时外排至细胞质而被利用。研究表明,人类ATP结合盒式(ABC)转运蛋白ABCD4定位于溶酶体膜上,可能在溶酶体内维生素B12外排至细胞质过程中起到关键作用。ABCD4基因的突变可能导致一系列先天性维生素B12缺陷病。其症状表现为肌张力减退、骨髓抑制、巨红细胞性贫血和心脏病等。然而,溶酶体内维生素B12外排的分子机制却不清楚,制约了对相关疾病的深入了解和治疗。
科研人员对临床上该蛋白的突变体致病机理进行分析。研究发现,临床样本的突变会破坏蛋白质分子内部(引入二硫键)或与ATP分子之间(盐桥)的相互作用,或者使蛋白错误折叠,最终导致蛋白无法正常催化ATP水解或发生构想变化,引发相关疾病。研究人员又将这些突变版本的蛋白构建在脂质体上利用生化活性进一步验证了结构分析的预测。同时,基于结构他们提出了ABCD4的转运机制。由于定位于溶酶体膜上,ABCD4采用不同于经典ABC外排蛋白的反向转运机制来外排维生素B12。
该项研究不仅对于该类蛋白的分子结构研究具有重要的参考意义,也为相关疾病的致病机理研究以及药物开发设计提供了理论指导。
维生素B12仅能在自然界少数细菌和古细菌中合成,而其作为一种人类必需的营养物质,只能从食物中摄取。维生素B12通过受体介导的内吞作用进入细胞,随后以游离形态储存于溶酶体中,需要时外排至细胞质而被利用。研究表明,人类ATP结合盒式(ABC)转运蛋白ABCD4定位于溶酶体膜上,可能在溶酶体内维生素B12外排至细胞质过程中起到关键作用。ABCD4基因的突变可能导致一系列先天性维生素B12缺陷病。其症状表现为肌张力减退、骨髓抑制、巨红细胞性贫血和心脏病等。然而,溶酶体内维生素B12外排的分子机制却不清楚,制约了对相关疾病的深入了解和治疗。
科研人员对临床上该蛋白的突变体致病机理进行分析。研究发现,临床样本的突变会破坏蛋白质分子内部(引入二硫键)或与ATP分子之间(盐桥)的相互作用,或者使蛋白错误折叠,最终导致蛋白无法正常催化ATP水解或发生构想变化,引发相关疾病。研究人员又将这些突变版本的蛋白构建在脂质体上利用生化活性进一步验证了结构分析的预测。同时,基于结构他们提出了ABCD4的转运机制。由于定位于溶酶体膜上,ABCD4采用不同于经典ABC外排蛋白的反向转运机制来外排维生素B12。
该项研究不仅对于该类蛋白的分子结构研究具有重要的参考意义,也为相关疾病的致病机理研究以及药物开发设计提供了理论指导。